




近日,,國(guó)家藥監(jiān)局印發(fā)《關(guān)于發(fā)布體外診斷試劑分類目錄的公告》(2024年第58號(hào),以下簡(jiǎn)稱《分類目錄》)及《關(guān)于實(shí)施〈體外診斷試劑分類目錄〉有關(guān)事項(xiàng)的通告》(2024年第17號(hào),以下簡(jiǎn)稱《實(shí)施通告》)。現(xiàn)就《分類目錄》修訂背景及相關(guān)內(nèi)容說明如下:
一,、《分類目錄》修訂背景
分類管理是醫(yī)療器械監(jiān)管的重要基礎(chǔ)性制度,分類目錄是分類管理的重要組成部分,?!?/span>6840體外診斷試劑分類子目錄(2013版)》(以下簡(jiǎn)稱2013版目錄)于2013年發(fā)布,后續(xù)又發(fā)布了《關(guān)于過敏原類,、流式細(xì)胞儀配套用,、免疫組化和原位雜交類體外診斷試劑產(chǎn)品屬性及類別調(diào)整的通告》(國(guó)家食品藥品監(jiān)督管理總局通告2017年第226號(hào),以下簡(jiǎn)稱226號(hào)通告)和《關(guān)于調(diào)整〈6840體外診斷試劑分類子目錄(2013版)〉部分內(nèi)容的公告》(國(guó)家藥品監(jiān)督管理局公告2020年第112號(hào),,以下簡(jiǎn)稱112號(hào)公告),,對(duì)體外診斷試劑產(chǎn)品管理類別予以明確。上述文件對(duì)體外診斷試劑的監(jiān)管和行業(yè)發(fā)展起到了積極的推動(dòng)作用,。
近年來,,體外診斷技術(shù)和產(chǎn)業(yè)快速發(fā)展,新技術(shù),、新方法,、新靶標(biāo)不斷涌現(xiàn),產(chǎn)品數(shù)量和種類急劇上升,。2013版目錄,、226號(hào)通告和112號(hào)公告不能完全滿足監(jiān)管和產(chǎn)業(yè)需求,且部分產(chǎn)品管理類別與2021年10月發(fā)布的《體外診斷試劑分類規(guī)則》(以下簡(jiǎn)稱《分類規(guī)則》)不完全一致,。因此,,國(guó)家藥監(jiān)局組織開展了《分類目錄》修訂工作。
二,、《分類目錄》結(jié)構(gòu)
《分類目錄》以《分類規(guī)則》為依據(jù),,根據(jù)體外診斷試劑的特點(diǎn)編制而成,《分類目錄》結(jié)構(gòu)由"一級(jí)序號(hào),、一級(jí)產(chǎn)品類別,、二級(jí)序號(hào)、二級(jí)產(chǎn)品類別,、預(yù)期用途,、管理類別"六個(gè)部分組成,其中"一級(jí)產(chǎn)品類別"主要依據(jù)《分類規(guī)則》設(shè)立,,共25個(gè),;"二級(jí)產(chǎn)品類別"是在一級(jí)產(chǎn)品類別項(xiàng)下的進(jìn)一步細(xì)化,主要根據(jù)檢測(cè)靶標(biāo)設(shè)置,,原則上不包括方法或原理,,共1852項(xiàng)。
《分類目錄》中"預(yù)期用途"涉及的內(nèi)容包括被測(cè)物及主要臨床用途等,,其目的主要是用于確定產(chǎn)品的管理類別,,不代表對(duì)相關(guān)產(chǎn)品注冊(cè)內(nèi)容的完整描述,。
對(duì)僅提供輔助診斷信息的流式細(xì)胞儀用單一抗體試劑及同型對(duì)照抗體、僅提供輔助診斷信息的免疫組化用單一抗體試劑,、僅提供輔助診斷信息的原位雜交用單一探針試劑的預(yù)期用途中均限定不得用于指導(dǎo)臨床用藥或伴隨診斷,。
分類編碼繼續(xù)沿用6840,以避免已注冊(cè)體外診斷試劑產(chǎn)品因分類編碼調(diào)整而變更注冊(cè),、變更生產(chǎn)許可等,,減少對(duì)行業(yè)的影響。
三,、 管理類別劃分原則解讀
?。ㄒ唬?/span> 被測(cè)物相同但在臨床上用于不同預(yù)期用途、且根據(jù)《分類規(guī)則》屬于不同管理類別的產(chǎn)品,,若其在不同管理類別的用途都有較廣泛的應(yīng)用,,則依據(jù)《分類規(guī)則》分別列入相應(yīng)管理類別,低類別條目的預(yù)期用途描述中應(yīng)明確不包含按高類別管理的預(yù)期用途,。例如下表所示,。
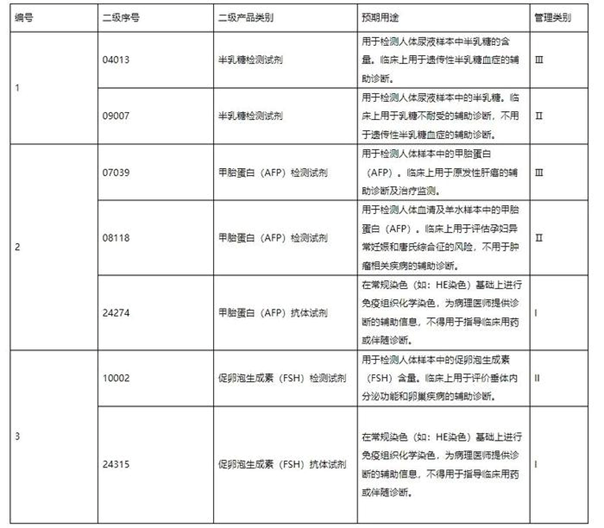
(二)對(duì)于具有多種預(yù)期用途,、但根據(jù)《分類規(guī)則》管理類別相同的產(chǎn)品,,進(jìn)行"一級(jí)產(chǎn)品類別"歸類時(shí),根據(jù)臨床主要用途,、特定用途優(yōu)先歸類,。例如,用于檢測(cè)人類基因的分子診斷產(chǎn)品,,若具有遺傳性疾病檢測(cè),、治療藥物靶點(diǎn)檢測(cè)或者腫瘤篩查、診斷,、輔助診斷等特定用途,則按其主要用途確定一級(jí)產(chǎn)品類別為"04 與遺傳性疾病檢測(cè)相關(guān)的試劑",、"06 與治療藥物靶點(diǎn)檢測(cè)相關(guān)的試劑和伴隨診斷用試劑"或"07 與腫瘤篩查,、診斷、輔助診斷,、分期相關(guān)的試劑",;若不具備此三種特定用途,則歸屬于"03 與人類基因檢測(cè)相關(guān)的試劑",。
?。ㄈ?/span>按112號(hào)公告降為二類的部分用于治療監(jiān)測(cè)、預(yù)后觀察的腫瘤標(biāo)志物,,不再單獨(dú)增加一級(jí)產(chǎn)品類別,,按成分歸入第二類"用于蛋白質(zhì)檢測(cè)的試劑"等產(chǎn)品類別中,。
(四)根據(jù)《分類規(guī)則》第六條,,將除基因檢測(cè)以外的人類白細(xì)胞抗原B27(HLA-B27)檢測(cè)試劑由三類降為二類管理,。
(五)對(duì)符合《分類規(guī)則》且風(fēng)險(xiǎn)較低的,、僅做選擇性培養(yǎng),、不具備鑒別及藥敏功能的微生物培養(yǎng)基,將其管理類別調(diào)整為第一類,。包括厭氧菌血瓊脂培養(yǎng)基,、HE瓊脂培養(yǎng)基、XLD瓊脂培養(yǎng)基,、沙門氏志賀氏(SS)瓊脂培養(yǎng)基,、WS瓊脂培養(yǎng)基、哥倫比亞血瓊脂培養(yǎng)基,、布魯氏菌血瓊脂(BBA)培養(yǎng)基,、改良淋病奈瑟菌選擇性瓊脂培養(yǎng)基(MTM瓊脂培養(yǎng)基)、淋病奈瑟菌培養(yǎng)基,、TM(Thayer-Martin)淋球菌培養(yǎng)基,、麥康凱瓊脂培養(yǎng)基、山梨醇麥康凱培養(yǎng)基,、中國(guó)藍(lán)瓊脂培養(yǎng)基,、伊紅美藍(lán)瓊脂培養(yǎng)基、海氏腸道瓊脂培養(yǎng)基,、慶大霉素瓊脂培養(yǎng)基,、硫檸膽蔗瓊脂培養(yǎng)基(TCBS瓊脂培養(yǎng)基)、鏈霉素月桂基硫酸鈉亞碲酸鉀瓊脂培養(yǎng)基,、軍團(tuán)菌瓊脂培養(yǎng)基,、高鹽甘露醇瓊脂培養(yǎng)基、Baird-Parker瓊脂培養(yǎng)基,、淋球菌培養(yǎng)浸片,、CLED瓊脂培養(yǎng)基、沙保弱(羅)瓊脂培養(yǎng)基,、毛滴蟲培養(yǎng)基,、雙相顯色體液培養(yǎng)瓶、L型細(xì)菌增菌培養(yǎng)基,、雙相血培養(yǎng)瓶,、嗜血桿菌巧克力瓊脂選擇培養(yǎng)基。
?。┌凑盏谝活惞芾淼募?xì)胞培養(yǎng)基,,僅保留基礎(chǔ)培養(yǎng)基產(chǎn)品,,如RPMI-1640 培養(yǎng)基,并根據(jù)《分類規(guī)則》明確用途限制(不用于細(xì)胞治療,、細(xì)胞回輸,、輔助生殖等非體外診斷用途)。對(duì)于已備案的明確所培養(yǎng)的細(xì)胞類型,、細(xì)胞來源,,但不能明確其預(yù)期用途的細(xì)胞培養(yǎng)基產(chǎn)品,不列入《分類目錄》,,如上皮細(xì)胞培養(yǎng)基,、腫瘤細(xì)胞培養(yǎng)基、結(jié)直腸細(xì)胞培養(yǎng)基,、肝細(xì)胞培養(yǎng)基,、骨髓細(xì)胞培養(yǎng)基等。相關(guān)產(chǎn)品應(yīng)當(dāng)明確預(yù)期用途后申請(qǐng)分類界定,。
?。ㄆ撸└鶕?jù)《分類規(guī)則》第六條、第七條規(guī)定,,按照第一類管理的樣本處理用產(chǎn)品,,主要指檢測(cè)反應(yīng)發(fā)生前的樣本預(yù)處理階段所用的通用性產(chǎn)品,且不參與反應(yīng),。原則上此類產(chǎn)品僅包括儀器平臺(tái)通用或方法學(xué)通用的樣本處理用試劑,,不包括針對(duì)具體檢測(cè)項(xiàng)目的樣本處理用試劑。如樣本萃取液,,為可跨平臺(tái),、或同一儀器平臺(tái),或同一方法學(xué)使用的非特異性試劑,,預(yù)期用于對(duì)待測(cè)樣本進(jìn)行分析前預(yù)處理,,溶解細(xì)胞,萃取出待測(cè)物,。其本身并不直接參與檢測(cè),,按第一類管理。
?。ò耍?/span>按照第一類管理的反應(yīng)體系通用試劑,主要指檢測(cè)反應(yīng)階段維持反應(yīng)體系環(huán)境的通用性試劑,。僅包括儀器平臺(tái)通用或方法學(xué)通用的反應(yīng)體系試劑,,如:化學(xué)發(fā)光免疫分析用底物液、化學(xué)發(fā)光免疫分析用發(fā)光液等,,不針對(duì)具體檢測(cè)項(xiàng)目,。不可對(duì)完整的產(chǎn)品進(jìn)行拆分后單獨(dú)注冊(cè)/備案,,如免疫檢測(cè)試劑、基因測(cè)序反應(yīng)試劑盒,、質(zhì)譜檢測(cè)試劑等,,不能拆分成多種組分后單獨(dú)注冊(cè)/備案。
?。ň牛┌凑盏谝活惞芾淼娜旧?,主要指通用性產(chǎn)品,不含特異性的蛋白,、抗原,、抗體、酶等物質(zhì),,按染色液主要化學(xué)成分或常用名稱命名,。如伊紅染色液、結(jié)晶紫染色液等,。
?。ㄊ└鶕?jù)《分類規(guī)則》,按照第一類管理的流式細(xì)胞儀用,、免疫組化,、原位雜交產(chǎn)品涉及的抗體或者探針,均為"單一抗體"或"單一探針",。原位雜交產(chǎn)品中針對(duì)單個(gè)基因檢測(cè)的斷裂基因探針,、融合基因探針,因其產(chǎn)品的特性,,需要兩個(gè)探針共同完成某個(gè)基因的檢測(cè),,視作"單一探針";原位雜交產(chǎn)品中針對(duì)單個(gè)基因檢測(cè)的,,產(chǎn)品的組成中除主要的特異性探針外,,另含有起"輔助定位"作用的探針的,視作"單一探針",。
根據(jù)《分類規(guī)則》,,上述按照第一類管理的"單一抗體"或"單一探針"組合后,應(yīng)當(dāng)按照第二類或第三類管理,。
?。ㄊ唬斗诸愐?guī)則》中"僅為專業(yè)醫(yī)生提供輔助診斷信息的流式細(xì)胞儀用單一抗體"限指對(duì)體液中懸浮的細(xì)胞進(jìn)行分析、提供輔助信息的單一抗體以及同型對(duì)照抗體,。通過捕獲體液中其他成分形成生物粒子,、從而用流式細(xì)胞儀進(jìn)行檢測(cè)的體外診斷試劑,不符合《分類規(guī)則》中"流式細(xì)胞儀用單一抗體"有關(guān)要求,。如在流式平臺(tái)上,,基于抗原抗體反應(yīng),,以特定"微珠"或者"微球"為載體,對(duì)白介素,、干擾素,、腫瘤壞死因子等物質(zhì)進(jìn)行檢測(cè)分析的試劑。12個(gè)流式細(xì)胞儀配套用產(chǎn)品由一類升為二類管理,,具體包括:α-干擾素檢測(cè)試劑,、γ-干擾素檢測(cè)試劑、白介素-1β檢測(cè)試劑,、白介素2檢測(cè)試劑,、白介素4檢測(cè)試劑、白介素5檢測(cè)試劑,、白介素6檢測(cè)試劑,、白介素8檢測(cè)試劑、白介素10檢測(cè)試劑,、白介素17檢測(cè)試劑,、白介素12p70檢測(cè)試劑、腫瘤壞死因子α檢測(cè)試劑,。
?。ㄊ┏冢ㄊl第二款列出的情形外,《分類目錄》中未包含的組合產(chǎn)品,,如組合后的預(yù)期用途僅為單項(xiàng)產(chǎn)品預(yù)期用途的組合,,則應(yīng)當(dāng)按照所包含的單項(xiàng)產(chǎn)品的最高管理類別確定其管理類別。如有新增預(yù)期用途,,應(yīng)當(dāng)按照相關(guān)要求申請(qǐng)分類界定,。
(十三)《分類目錄》未包括校準(zhǔn)品,、質(zhì)控品,。根據(jù)《分類規(guī)則》,與第二類,、第三類體外診斷試劑配合使用的校準(zhǔn)品和質(zhì)控品的類別,,與試劑類別相同;與第一類體外診斷試劑配合使用的校準(zhǔn)品和質(zhì)控品,,按第二類管理,。
非定值質(zhì)控品不作為醫(yī)療器械管理。
?。ㄊ模└鶕?jù)《分類規(guī)則》第六條,、第七條規(guī)定,與麻醉藥品,、精神藥品,、醫(yī)療用毒性藥品檢測(cè)相關(guān),并具有臨床診斷用途,、在臨床機(jī)構(gòu)使用的體外診斷試劑,,按第三類管理。麻醉藥品,、精神藥品或醫(yī)療用毒性藥品的范圍根據(jù)國(guó)家藥監(jiān)局,、公安部、國(guó)家衛(wèi)生健康委聯(lián)合發(fā)布的《麻醉藥品和精神藥品品種目錄》《醫(yī)療用毒性藥品管理辦法》所列的毒性藥品品種,,以及后續(xù)補(bǔ)充文件增加的品種進(jìn)行確定,。
四、醫(yī)療器械注冊(cè)備案管理有關(guān)政策
包括產(chǎn)品注冊(cè)備案相關(guān)要求,?!斗诸惸夸洝穼?shí)施過渡期根據(jù)首次注冊(cè)、延續(xù)注冊(cè),、變更注冊(cè)及備案等不同注冊(cè)/備案形式進(jìn)行了分別說明,,并以是否受理/備案為劃分節(jié)點(diǎn)??紤]到《分類目錄》發(fā)布后監(jiān)管部門及相關(guān)企業(yè)學(xué)習(xí)需一定時(shí)間,,因此,對(duì)于產(chǎn)品注冊(cè),,《分類目錄》自2025年1月1日起實(shí)施,;對(duì)于產(chǎn)品備案,為盡快指導(dǎo)和規(guī)范,,《分類目錄》自2024年7月1日起實(shí)施,。
(一)關(guān)于注冊(cè)證有效期
明確對(duì)于2025年1月1日前已批準(zhǔn)且已生效的體外診斷試劑注冊(cè)證,,無論按《分類目錄》管理類別是否調(diào)整,,在批準(zhǔn)的有效期內(nèi)依然繼續(xù)有效。
?。ǘ╆P(guān)于首次注冊(cè)
自2025年1月1日起應(yīng)當(dāng)按照新《分類目錄》受理產(chǎn)品注冊(cè)申請(qǐng),;2025年1月1日前已受理的,可以按原《分類目錄》進(jìn)行審評(píng)審批,,其中涉及類別調(diào)整的,,需在注冊(cè)證備注欄中注明新《分類目錄》管理類別,并限定醫(yī)療器械注冊(cè)證有效期不得超過2027年1月1日,。
?。ㄈ╆P(guān)于延續(xù)注冊(cè)
對(duì)于2025年1月1日前已受理但尚未作出審批決定的,按照原《分類目錄》繼續(xù)審評(píng)審批;準(zhǔn)予延續(xù)注冊(cè)的,,如按照新《分類目錄》不涉及產(chǎn)品管理類別調(diào)整,,則按照新《分類目錄》核發(fā)醫(yī)療器械注冊(cè)證;如按照新《分類目錄》涉及產(chǎn)品管理類別調(diào)整,,則繼續(xù)按照原《分類目錄》核發(fā)醫(yī)療器械注冊(cè)證,,在注冊(cè)證備注欄中注明新《分類目錄》產(chǎn)品管理類別,并限定醫(yī)療器械注冊(cè)證有效期不得超過2027年1月1日,。
對(duì)于在2025年1月1日前已批準(zhǔn)且已生效的醫(yī)療器械注冊(cè)證,,如涉及產(chǎn)品管理類別由高類別調(diào)整為低類別的,注冊(cè)人應(yīng)當(dāng)按照改變后的類別向相應(yīng)藥品監(jiān)督管理部門申請(qǐng)延續(xù)注冊(cè)或者辦理備案,。如涉及產(chǎn)品管理類別由低類別調(diào)整為高類別的,,注冊(cè)人應(yīng)當(dāng)按照改變后的類別向相應(yīng)藥品監(jiān)督管理部門申請(qǐng)注冊(cè);在原醫(yī)療器械注冊(cè)證有效期內(nèi)提出注冊(cè)申請(qǐng)的,,如在開展產(chǎn)品類別轉(zhuǎn)換工作期間注冊(cè)證到期,,注冊(cè)人可向原注冊(cè)部門提出原醫(yī)療器械注冊(cè)證延期申請(qǐng),予以延期的,,原則上原醫(yī)療器械注冊(cè)證有效期不得超過2027年1月1日,。
(四)關(guān)于變更注冊(cè)
對(duì)于2025年1月1日前已受理但尚未作出審批決定的,,按照原《分類目錄》繼續(xù)審評(píng)審批,;準(zhǔn)予變更注冊(cè)的,如按照新《分類目錄》不涉及產(chǎn)品管理類別調(diào)整,,則按照新《分類目錄》核發(fā)醫(yī)療器械變更注冊(cè)文件,;如按照新《分類目錄》涉及產(chǎn)品管理類別調(diào)整,則繼續(xù)按照原《分類目錄》核發(fā)醫(yī)療器械變更注冊(cè)文件,,并在備注欄中注明新《分類目錄》產(chǎn)品管理類別,。
對(duì)于在2025年1月1日前已批準(zhǔn)且已生效的醫(yī)療器械注冊(cè)證,涉及管理類別調(diào)整的,,如在醫(yī)療器械注冊(cè)證有效期內(nèi)發(fā)生注冊(cè)變更的,,注冊(cè)人可以向原注冊(cè)部門申請(qǐng)變更注冊(cè)。準(zhǔn)予變更注冊(cè)的,,核發(fā)醫(yī)療器械變更注冊(cè)文件,,并在備注欄中注明新《分類目錄》產(chǎn)品管理類別。再次強(qiáng)調(diào),,對(duì)涉及管理類別調(diào)整的,,注冊(cè)人應(yīng)當(dāng)按照新《分類目錄》產(chǎn)品管理類別向相應(yīng)藥品監(jiān)督管理部門申請(qǐng)注冊(cè)或者辦理備案。
?。ㄎ澹╆P(guān)于產(chǎn)品備案
自《分類目錄》發(fā)布之日至2024年6月30日,,可以按照原《分類目錄》辦理第一類體外診斷試劑備案,;鼓勵(lì)按照《分類目錄》辦理第一類體外診斷試劑產(chǎn)品備案。自2024年7月1日起,,應(yīng)當(dāng)按照新《分類目錄》辦理第一類體外診斷試劑產(chǎn)品備案,。
2024年7月1日前已備案的產(chǎn)品,備案人應(yīng)當(dāng)對(duì)照《分類目錄》對(duì)備案信息及備案資料進(jìn)行自查,。涉及變更備案,、取消備案的,備案人應(yīng)當(dāng)按照《關(guān)于第一類醫(yī)療器械備案有關(guān)事項(xiàng)的公告》辦理,。其中按照《分類目錄》涉及產(chǎn)品管理類別由低類別調(diào)整為高類別的,備案人應(yīng)當(dāng)按照改變后的類別向相應(yīng)藥品監(jiān)督管理部門申請(qǐng)注冊(cè),。自2027年1月1日起,,未依法取得注冊(cè)證的,不得生產(chǎn),、進(jìn)口和銷售,,在原備案有效期內(nèi)生產(chǎn)的產(chǎn)品自2027年1月1日起也不得銷售。
?。┢渌?/span>
一是原已注冊(cè)或備案的產(chǎn)品未納入《分類目錄》的,,注冊(cè)人/備案人應(yīng)當(dāng)按照醫(yī)療器械分類界定工作有關(guān)要求申請(qǐng)分類界定,并根據(jù)分類界定結(jié)果依照有關(guān)規(guī)定申請(qǐng)注冊(cè)或辦理備案,。如糖化血紅蛋白洗脫液,,該產(chǎn)品不能單獨(dú)實(shí)現(xiàn)臨床檢驗(yàn)用途,且不是通用性樣本處理用試劑,,因此應(yīng)當(dāng)與配合使用的其他試劑作為一個(gè)試劑盒注冊(cè),。又如富血小板血漿樣本提取試劑,其提取的富血小板血漿不用于體外診斷,,而是用于軟骨,、眼科、創(chuàng)傷等的治療,,因此不屬于體外診斷試劑的范疇,,未納入《分類目錄》。
二是鑒于《分類目錄》中"二級(jí)產(chǎn)品類別"原則上不包括方法或原理,,"預(yù)期用途"主要是用于確定產(chǎn)品的管理類別,、不代表對(duì)相關(guān)產(chǎn)品注冊(cè)內(nèi)容的完整描述,申請(qǐng)注冊(cè)或者辦理備案時(shí),,有關(guān)產(chǎn)品名稱和預(yù)期用途應(yīng)當(dāng)按照《體外診斷試劑注冊(cè)與備案管理辦法》及相關(guān)要求執(zhí)行,。
三是在辦理第一類產(chǎn)品備案時(shí),產(chǎn)品具體組成成分應(yīng)當(dāng)明示,,不應(yīng)使用諸如成分A,、成分B,、組分1、組分2等替代性描述,。如:一級(jí)產(chǎn)品類別21"樣本處理用產(chǎn)品"中的染色液類產(chǎn)品等,。
五、醫(yī)療器械生產(chǎn)經(jīng)營(yíng)許可備案有關(guān)政策
對(duì)醫(yī)療器械生產(chǎn)經(jīng)營(yíng)許可和備案中涉及分類相關(guān)內(nèi)容進(jìn)行了說明,。
來源:國(guó)家藥監(jiān)局網(wǎng)站
免責(zé)聲明:本站支持廣告法相關(guān)規(guī)定, 且已竭力規(guī)避使用“極限化違禁詞",如不慎出現(xiàn)僅代本站范圍內(nèi)對(duì)比,不支持以任何"違禁詞”為借口舉報(bào)我司違反《廣告法》的變相勒索行為!
本站部分素材來源互聯(lián)網(wǎng),,以傳播信息為目的進(jìn)行轉(zhuǎn)載,如涉及版權(quán)請(qǐng)直接與客服聯(lián)系,我們將及時(shí)更正刪除,謝謝,。